Modelo Atômico De Thomson – Todo Estudo: Embarque conosco numa jornada fascinante ao coração da matéria! Imagine um universo microscópico, onde partículas invisíveis a olho nu ditam as leis da natureza. A compreensão deste mundo começou com modelos atômicos, e o modelo de Thomson, com sua elegante simplicidade, representa um marco fundamental nesta épica busca pelo conhecimento.
Prepare-se para desvendar os segredos deste “pudim de passas” atômico, que, apesar de superado, pavimentou o caminho para as descobertas revolucionárias que se seguiram.
Exploraremos a genialidade de J.J. Thomson, suas experiências com raios catódicos e a construção de seu icônico modelo. Veremos como ele revolucionou a compreensão da estrutura atômica, desafiando o modelo anterior de Dalton e abrindo portas para novas teorias. Acompanhe a evolução científica, as evidências experimentais que sustentam e refutam o modelo, e o legado duradouro de Thomson na física moderna.
Uma viagem que irá iluminar sua compreensão do átomo e da própria constituição da matéria.
Experimentos e Evidências que Sustentam (ou Refutam) o Modelo de Thomson: Modelo Atômico De Thomson – Todo Estudo
A jornada rumo à compreensão da estrutura atômica foi pavimentada por experimentos ousados e observações perspicazes. O modelo atômico de Thomson, proposto no início do século XX, não foi uma ideia surgida do nada, mas sim o ápice de uma série de descobertas experimentais que revolucionaram a visão da matéria. Sua genialidade reside na interpretação de dados que, até então, pareciam desconexos.
O estudo dos raios catódicos desempenhou um papel fundamental na construção do modelo de Thomson. Imagine um tubo de vidro selado, quase um vácuo, com dois eletrodos – um cátodo (negativo) e um ânodo (positivo) – em suas extremidades. Ao aplicar uma alta voltagem, um feixe luminoso, os raios catódicos, é emitido pelo cátodo, viajando em linha reta até o ânodo.
Essa observação, repetida inúmeras vezes com variações nas condições experimentais, forneceu pistas cruciais sobre a natureza da matéria.
Propriedades dos Raios Catódicos e a Estrutura Atômica

As propriedades dos raios catódicos revelaram características surpreendentes. Observou-se que eles eram independentes do material do cátodo, sugerindo que eram constituídos por partículas fundamentais presentes em toda a matéria. A deflexão dos raios catódicos em campos elétricos e magnéticos comprovou sua natureza carregada negativamente. Medindo a razão entre a carga e a massa (e/m) dessas partículas, os cientistas conseguiram estimar seu tamanho e sua massa, indicando que eram muito menores que os átomos.
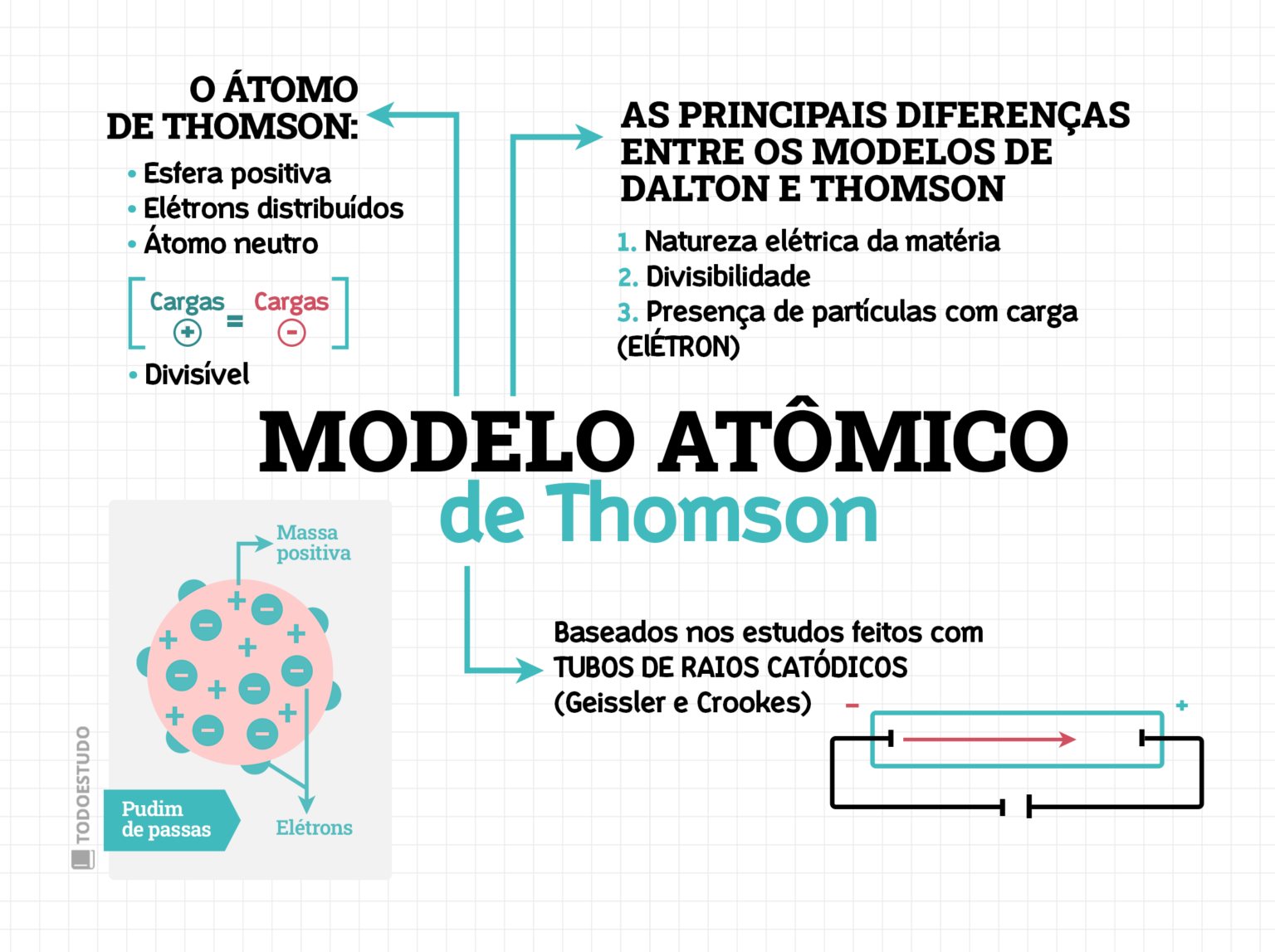
Essas observações foram essenciais para Thomson propor que os átomos não eram maciços e indivisíveis, como se acreditava anteriormente, mas sim possuíam partículas subatômicas carregadas negativamente, que ele chamou de elétrons.
Evidências Experimentais que Apoiaram o Modelo de Thomson, Modelo Atômico De Thomson – Todo Estudo
O modelo do “pudim de passas”, como ficou conhecido, propunha que o átomo era uma esfera de carga positiva na qual os elétrons estavam incrustados, como passas em um pudim. A neutralidade elétrica do átomo era explicada pelo equilíbrio entre a carga positiva da esfera e a carga negativa dos elétrons. A principal evidência experimental que sustentou essa ideia foi a própria existência e as propriedades dos raios catódicos.
A constatação de que essas partículas negativas eram comuns a todos os materiais sugeria que elas eram constituintes fundamentais de todos os átomos.
Limitações do Modelo de Thomson e Descobertas Posteriores

Apesar de revolucionário, o modelo de Thomson tinha limitações. Ele não conseguia explicar a estabilidade dos átomos e não previu a existência do núcleo atômico. Experimentos posteriores, como o famoso experimento de espalhamento de partículas alfa de Rutherford, revelaram que a maior parte da massa e da carga positiva do átomo estavam concentradas em um pequeno núcleo central, refutando a ideia de uma distribuição uniforme da carga positiva proposta por Thomson.
Descobertas Experimentais e a Evolução dos Modelos Atômicos
A evolução dos modelos atômicos é um testemunho da busca incessante pela compreensão da matéria. A descoberta dos raios catódicos e suas propriedades, a determinação da razão carga/massa do elétron, e a posterior descoberta do núcleo atômico por Rutherford, foram marcos cruciais nesse processo. Cada experimento trouxe novas informações, refutando modelos antigos e abrindo caminho para teorias mais precisas e abrangentes sobre a estrutura atômica.
A trajetória científica, portanto, não é linear, mas sim um processo iterativo de descoberta, refutação e aprimoramento, onde cada modelo, mesmo que temporariamente superado, contribui para o avanço do conhecimento.
Implicações e Legado do Modelo Atômico de Thomson
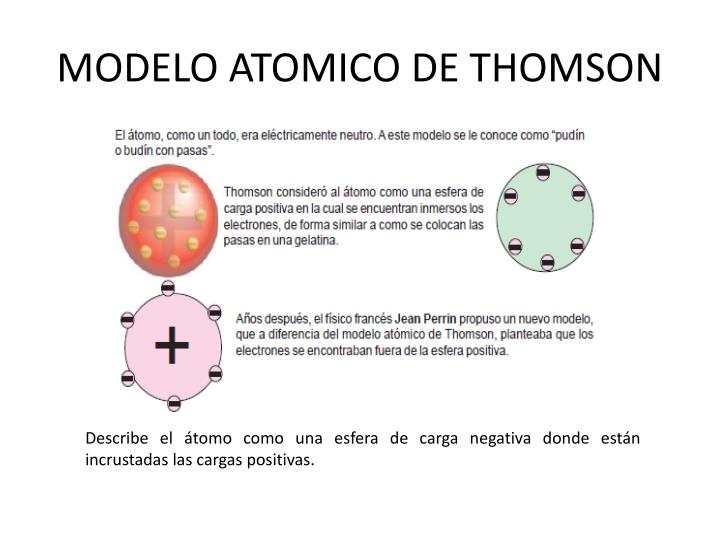
O modelo atômico de Thomson, apesar de posteriormente refutado, representa um marco fundamental na história da física atômica. Sua proposta, embora simplificada, quebrou paradigmas e abriu caminho para uma compreensão mais profunda da estrutura da matéria, influenciando diretamente as pesquisas e modelos subsequentes. A jornada rumo à compreensão do átomo não foi linear, mas sim um processo iterativo de construção e reconstrução de modelos, com o modelo de Thomson ocupando um lugar de destaque nessa trajetória evolutiva.O modelo de Thomson, também conhecido como o “modelo do pudim de passas”, foi crucial para o desenvolvimento da física atômica por introduzir o conceito de que o átomo não era uma partícula indivisível, mas sim uma estrutura complexa contendo partículas carregadas.
Essa concepção inovadora desafiou o modelo atômico anterior, considerado sólido e indivisível, pavimentando o caminho para a descoberta de novas partículas subatômicas e para o desenvolvimento de modelos mais sofisticados, como o modelo nuclear de Rutherford. A influência de Thomson é inegável na história da ciência, sendo um passo essencial na construção do conhecimento que temos hoje sobre a matéria.
Influência do Modelo de Thomson em Modelos Posteriores
O modelo de Thomson, apesar de suas limitações, serviu como um trampolim para o modelo atômico de Rutherford. A ideia de que o átomo continha partículas carregadas, positiva e negativamente, foi essencial para Rutherford conceber seu experimento com partículas alfa e, consequentemente, propor um modelo em que a carga positiva estava concentrada em um núcleo pequeno e denso, com os elétrons orbitando ao redor.
Sem a contribuição de Thomson, a concepção do modelo nuclear de Rutherford seria impensável. A evolução do conhecimento científico se assemelha a uma construção arquitetônica, onde cada modelo atômico, incluindo o de Thomson, representa um tijolo fundamental na edificação do conhecimento completo.
Impacto do Modelo de Thomson na Compreensão da Eletricidade e da Matéria
O modelo atômico de Thomson revolucionou a compreensão da eletricidade e da matéria ao conectar, pela primeira vez de forma consistente, a estrutura atômica com as propriedades elétricas da matéria. A ideia de que os átomos continham partículas carregadas explicou, de maneira intuitiva, fenômenos como a condutividade elétrica em metais e a eletrização por atrito. Antes de Thomson, a relação entre a estrutura atômica e as propriedades elétricas da matéria era um mistério.
Seu modelo forneceu um arcabouço conceitual que permitiu aos cientistas relacionarem a estrutura interna dos átomos com suas propriedades macroscópicas, abrindo novas possibilidades de investigação e compreensão.
Contribuições de Thomson para a Ciência
J.J. Thomson não se limitou à proposta de seu modelo atômico. Suas contribuições para a ciência foram vastas e abrangem diversas áreas da física. Além de descobrir o elétron e propor seu modelo atômico, Thomson realizou trabalhos importantes em espectroscopia, condutividade elétrica em gases e raios catódicos, contribuindo significativamente para o desenvolvimento da física moderna. Sua influência se estende para além de seu modelo atômico, impactando gerações de cientistas e moldando o curso da pesquisa científica em física.
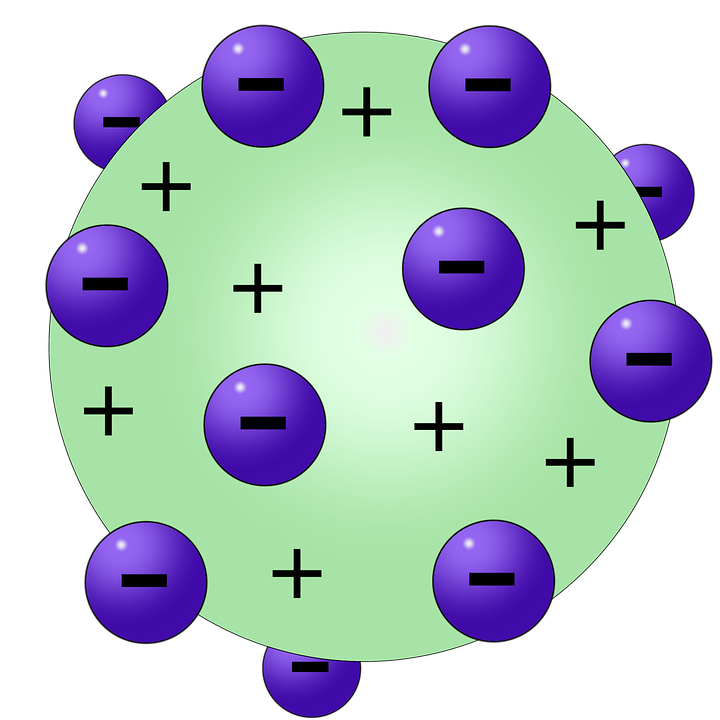
O “Pudim de Passas”: Uma Metáfora do Modelo Atômico de Thomson
O modelo atômico de Thomson é frequentemente descrito como um “pudim de passas”. Imagine um pudim de consistência uniforme, representando uma esfera de carga positiva. Espalhadas por toda essa esfera, como passas em um pudim, encontram-se as partículas negativas, os elétrons. A carga positiva do “pudim” neutraliza a carga negativa das “passas”, resultando em um átomo eletricamente neutro.
Essa imagem simples, embora não totalmente precisa, captura a essência do modelo de Thomson: um átomo constituído por uma distribuição uniforme de carga positiva na qual os elétrons estão incrustados, assegurando a neutralidade elétrica do átomo como um todo. A simplicidade da metáfora facilitou a compreensão e disseminação do modelo, mesmo entre aqueles que não tinham um profundo conhecimento de física.

