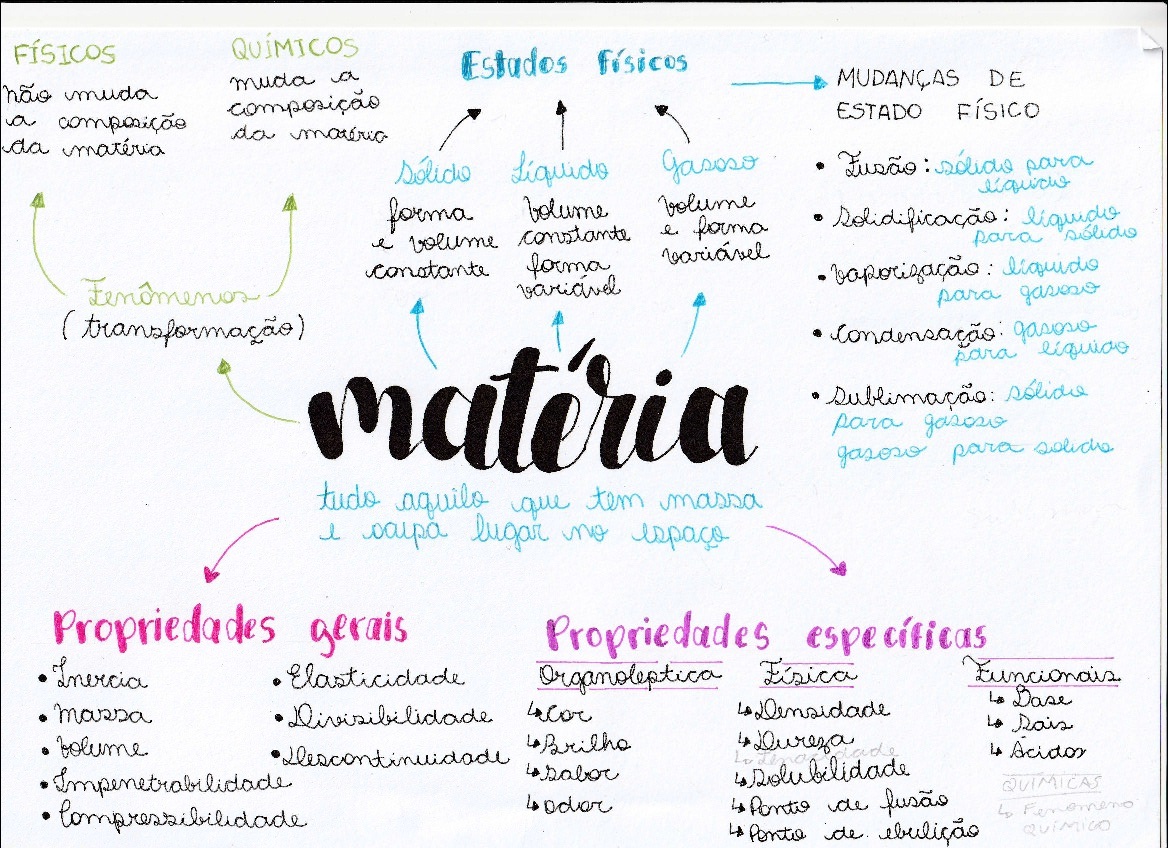
Propriedades Específicas Da Matéria | 2024 | Conceitos De Química: embarque numa jornada fascinante pelo mundo microscópico da matéria! Desvendaremos os segredos que regem a organização da matéria, desde a dança das moléculas nos estados físicos até as transformações químicas que moldam o universo ao nosso redor. Prepare-se para explorar as propriedades que definem a identidade de cada substância, compreendendo como suas características intrínsecas e extrínsecas ditam seu comportamento e interações.
Neste estudo aprofundado, analisaremos os estados físicos da matéria – sólido, líquido e gasoso – comparando suas propriedades macroscópicas e as forças intermoleculares que os governam. Mergulharemos no fascinante mundo das reações químicas, observando como as propriedades químicas se transformam e como podemos representá-las através de equações. Finalmente, distinguiremos entre propriedades intensivas e extensivas, ferramentas essenciais para a identificação e caracterização de substâncias.
A compreensão destes conceitos é fundamental para desvendar os mistérios da química e o funcionamento do mundo que nos cerca.
Estados Físicos da Matéria e suas Propriedades: Propriedades Específicas Da Matéria | 2024 | Conceitos De Química
A matéria, a base de tudo o que nos cerca, apresenta-se em diferentes estados físicos, cada um com características únicas que moldam o mundo que conhecemos. A compreensão desses estados – sólido, líquido e gasoso – e suas propriedades intrínsecas é fundamental para a química e para a compreensão dos fenômenos naturais. Vamos embarcar numa jornada para desvendar os segredos dessas transformações fascinantes.
Propriedades Macroscópicas dos Estados Físicos da Matéria

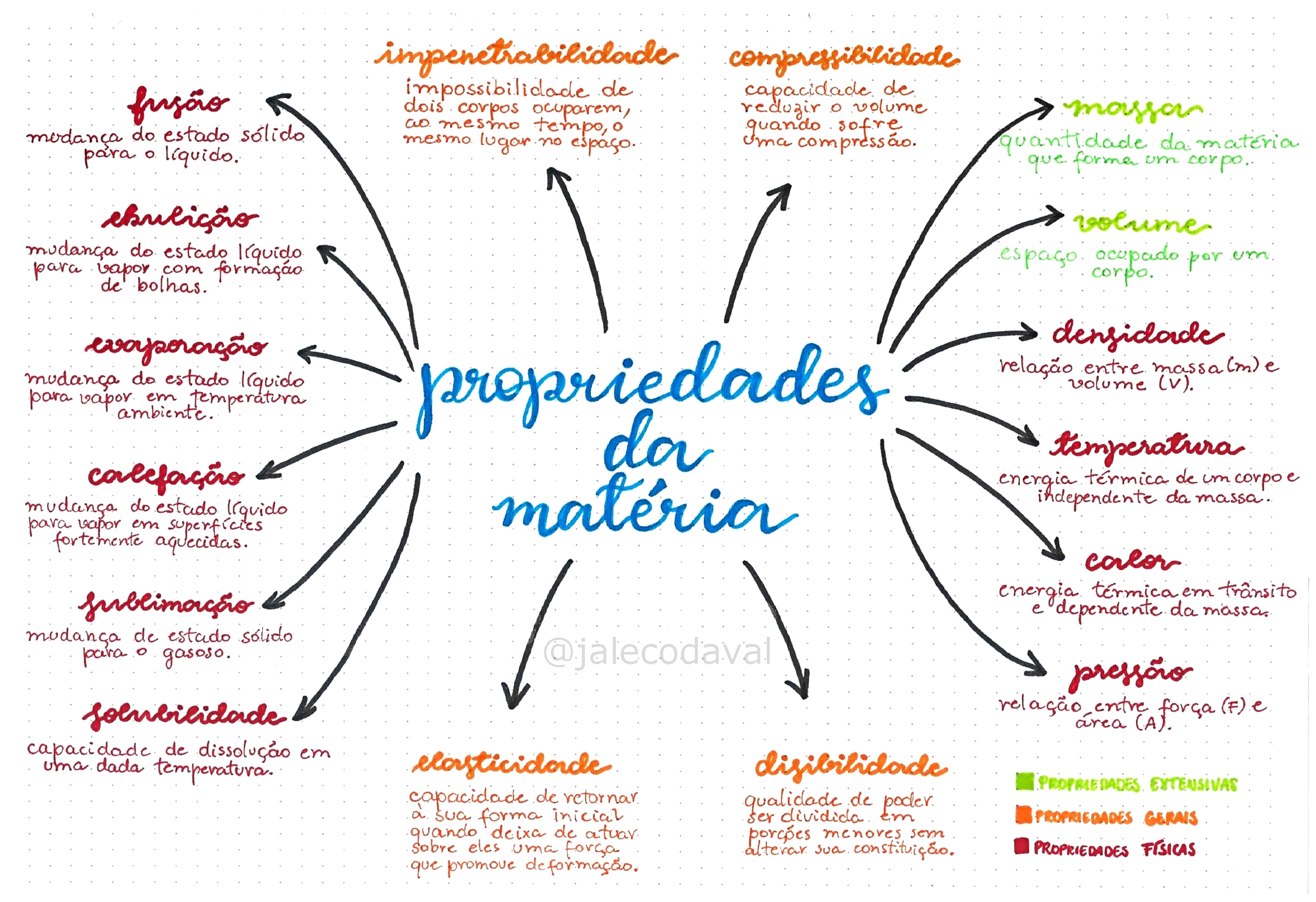
A matéria, em seus diversos estados, exibe propriedades macroscópicas que podemos observar e medir diretamente. Estas propriedades nos fornecem uma visão clara das diferenças entre sólidos, líquidos e gases, permitindo-nos classificá-los e prever seu comportamento. A tabela abaixo resume essas propriedades:
| Propriedade | Sólido | Líquido | Gasoso |
|---|---|---|---|
| Volume | Definitivo | Definitivo | Indefinido (ocupa o volume do recipiente) |
| Forma | Definitiva | Indefinida (assume a forma do recipiente) | Indefinida (assume a forma do recipiente) |
| Massa | Definitiva | Definitiva | Definitiva |
| Densidade | Geralmente alta | Intermediária | Baixa |
Mudança de Estado Físico da Água: Um Exemplo Prático, Propriedades Específicas Da Matéria | 2024 | Conceitos De Química
A água, substância essencial à vida, serve como um exemplo perfeito para ilustrar as mudanças de estado físico. Ao aquecermos um cubo de gelo (água no estado sólido), a energia térmica aumenta a vibração das moléculas de água, rompendo as ligações de hidrogênio que as mantêm rigidamente unidas. O gelo derrete, transformando-se em água líquida. Neste processo, o volume diminui ligeiramente, a forma torna-se indefinida, mas a massa permanece constante.
Continuando o aquecimento, a água líquida atinge o ponto de ebulição, e a energia térmica supera as forças intermoleculares, fazendo com que as moléculas escapem para o estado gasoso, formando vapor. Aqui, o volume aumenta drasticamente, a forma torna-se completamente indefinida, mas a massa permanece inalterada. A densidade também muda significativamente em cada fase: o gelo é menos denso que a água líquida, e o vapor é muito menos denso que ambos.
Forças Intermoleculares e suas Influências nas Propriedades da Matéria
As forças intermoleculares, atrações entre as moléculas, desempenham um papel crucial na determinação do estado físico da matéria e suas propriedades. Em sólidos, as forças intermoleculares são fortes, mantendo as moléculas em posições fixas e conferindo-lhes forma e volume definidos. Nos líquidos, essas forças são mais fracas, permitindo que as moléculas se movam umas em relação às outras, resultando em volume definido, mas forma indefinida.
Nos gases, as forças intermoleculares são extremamente fracas, permitindo que as moléculas se movam livremente, ocupando todo o volume disponível. A intensidade dessas forças influencia diretamente propriedades como ponto de fusão, ponto de ebulição e viscosidade. Por exemplo, a alta viscosidade do mel se deve às fortes forças intermoleculares entre suas moléculas, enquanto a baixa viscosidade da água reflete a menor intensidade dessas forças.
Propriedades Químicas e Reações Químicas
A jornada pela compreensão da matéria nos leva agora a um reino fascinante: o das propriedades químicas e das reações químicas. Enquanto as propriedades físicas descrevem a aparência e o comportamento da matéria sem alterar sua composição, as propriedades químicas revelam sua capacidade de transformar-se, de reagir com outras substâncias, criando novas com características distintas. É nesse mundo de transformações que a verdadeira natureza da matéria se revela.
Reações Químicas e Mudanças nas Propriedades Químicas
As reações químicas são eventos que envolvem a reorganização de átomos e moléculas, resultando em mudanças fundamentais nas propriedades da matéria. Essas mudanças são mais do que simples alterações de estado físico; elas representam a formação de novas substâncias com identidades químicas diferentes. Observemos três exemplos que ilustram essa transformação profunda:
- Combustão do Metano: A queima do metano, o principal componente do gás natural, é uma reação exotérmica que libera energia na forma de calor e luz. O metano (CH₄), um gás incolor e inodoro, reage com o oxigênio (O₂) do ar, produzindo dióxido de carbono (CO₂), um gás que contribui para o efeito estufa, e água (H₂O), um líquido essencial à vida.
A equação balanceada é:
CH₄ + 2O₂ → CO₂ + 2H₂O
Note a transformação completa do metano em novas substâncias com propriedades químicas totalmente diferentes.
- Reação de Neutralização: A reação entre um ácido e uma base é um exemplo clássico de reação química que altera as propriedades químicas dos reagentes. Quando um ácido, como o ácido clorídrico (HCl), reage com uma base, como o hidróxido de sódio (NaOH), ocorre uma neutralização, formando sal e água. As propriedades corrosivas do ácido e a natureza cáustica da base desaparecem, dando lugar a um produto com características bem diferentes.
A equação balanceada é:
HCl + NaOH → NaCl + H₂O
- Reação de Oxidação do Ferro: A ferrugem é o resultado da oxidação do ferro (Fe) na presença de oxigênio (O₂) e água (H₂O). O ferro metálico, um sólido dúctil e maleável, transforma-se em óxido de ferro (Fe₂O₃), um composto quebradiço e com propriedades químicas distintas. Essa reação, que deteriora estruturas de ferro e aço, demonstra a alteração significativa das propriedades químicas do metal. A equação simplificada é:
4Fe + 3O₂ + 6H₂O → 4Fe(OH)₃
Diferença entre Propriedades Químicas e Físicas
Compreender a distinção entre propriedades químicas e físicas é crucial para a análise e previsão do comportamento da matéria. Propriedades físicas podem ser observadas e medidas sem alterar a composição da substância, enquanto as propriedades químicas só se manifestam durante uma reação química, resultando em mudanças na composição.
- Propriedades Físicas: Ponto de fusão (a temperatura em que uma substância muda do estado sólido para o líquido), ponto de ebulição (a temperatura em que uma substância muda do estado líquido para o gasoso), densidade (massa por unidade de volume), cor, odor, dureza, maleabilidade, condutividade elétrica e térmica. Por exemplo, o gelo derrete a 0°C, a água ferve a 100°C (sob pressão atmosférica normal), o ouro é um metal amarelo e maleável.
- Propriedades Químicas: Inflamabilidade (capacidade de uma substância queimar), reatividade com ácidos ou bases, capacidade de oxidação ou redução, estabilidade química (tendência de uma substância se decompor), toxicidade. Por exemplo, o sódio reage violentamente com a água, o etanol é inflamável, o ferro enferruja em contato com o ar e a água.
Composição Química e Propriedades Químicas
A composição química de uma substância, ou seja, os tipos e proporções de átomos que a constituem, determina diretamente suas propriedades químicas. A interação entre os átomos, suas ligações e a estrutura molecular influenciam profundamente a reatividade e o comportamento da substância. Imagine um diagrama com um círculo central representando uma molécula. Dentro do círculo, estão representados os diferentes átomos que compõem a molécula, com seus símbolos químicos e quantidades. Partindo do círculo central, setas apontam para caixas retangulares representando diferentes propriedades químicas, como “reatividade com água”, “ponto de inflamabilidade”, “estabilidade térmica”. Cada seta é rotulada com uma breve descrição de como a composição da molécula afeta a propriedade específica. Por exemplo, uma seta apontando para “reatividade com água” poderia ter a legenda: “A presença de átomos eletropositivos, como o sódio, aumenta a reatividade com a água, devido à formação de íons”. Outro exemplo, uma seta apontando para “estabilidade térmica” poderia dizer: “Ligações covalentes fortes entre os átomos resultam em alta estabilidade térmica”. Este diagrama ilustra a relação direta e fundamental entre a composição química e as propriedades químicas da matéria.

